
2025年12月,我国自主研发的创新型双靶点生物制剂泰它西普,其治疗重症肌无力(抗乙酰胆碱受体抗体阳性的成人全身型重症肌无力)的新适应症正式被纳入国家医保目录,将于2026年1月1日起执行。这将有力推动重症肌无力治疗向着更高效、更普惠的方向迈进。
重症肌无力(MG)是获得性神经-肌肉接头传递障碍的自身免疫性疾病,乙酰胆碱受体(AChR)抗体是最常见的致病性抗体。肌无力常从单一肌群开始,逐渐累及其他肌群直至全身,转化为全身型MG(gMG)。
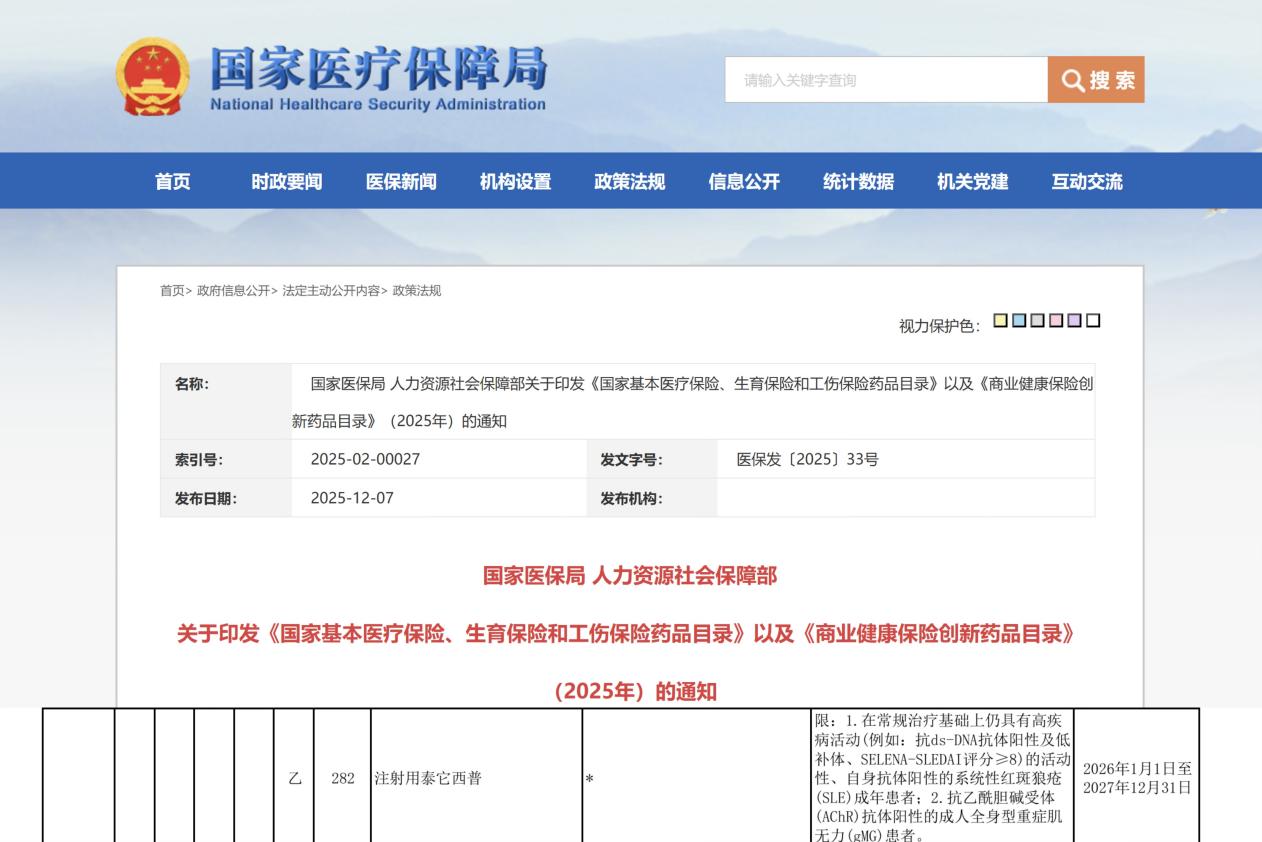
2025年5月我国自主研发的创新型双靶点生物制剂注射用泰它西普获国家药品监督管理局批准,新增第三个适应症,适用于抗AChR抗体阳性的成人gMG患者。2025年12月7日发布的《2025年国家基本医疗保险、工伤保险和生育保险药品目录》,泰它西普治疗gMG的适应症首次被纳入其中,成为新版医保目录中gMG领域唯一采用皮下注射且新增的生物制剂。
据了解,泰它西普是一种注射用重组人B淋巴细胞刺激因子受体-抗体融合蛋白,可同时抑制B淋巴细胞刺激因子(BLyS)和增殖诱导配体(APRIL)过度表达,阻止B细胞异常分化和成熟,减少MG相关自身抗体的产生,从而发挥治疗作用。通过精准地识别并耗竭异常活跃的、可能导致自身免疫性疾病的B细胞,泰它西普可以助力患者重建一个更加稳定和谐的免疫环境,换言之,其不仅有助于控制疾病本身活动性,还减少了由于免疫系统过度耗竭而引起的感染风险。总体而言,泰它西普这种直击致病性抗体产生源头的“双靶点、上游阻断、对因治疗”的作用机制有助于减轻自身免疫反应,重塑免疫稳态,进而持久改善MG患者的症状。故在今年发布的《中国重症肌无力诊断和治疗指南(2025版)》中,推荐泰它西普用于治疗抗AChR抗体阳性gMG成人患者。
资料显示,今年4月于美国召开的第77届神经病学学会年会(AAN)会议上公布了泰它西普针对成人gMG的Ⅲ期临床数据,验证了泰它西普在快速、显著、持续改善gMG患者临床症状方面的疗效,同时还具备可靠安全性。
泰它西普作为新版医保目录中gMG领域唯一采用皮下注射且新增的生物制剂,其推荐使用剂量为240mg/次,每周皮下注射一次,患者可居家使用。这一给药方式具有使用便捷、患者可居家自行操作、减少反复就医奔波、提高治疗依从性等优势。
泰它西普凭借其独特的双靶点机制,在显著提升疗效的同时保障治疗安全,有效助力重症肌无力“双达标”治疗目标的落地。今年,其全身型重症肌无力新适应症在国内获批,并成功纳入最新国家医保目录,泰它西普有望为国内约20万名患者提供一种疗效确切、用药便捷且更可负担的治疗新选择。
责任编辑:李 震
赤盈配资-交易配资网-股市配资合法吗-股票配资学习网提示:文章来自网络,不代表本站观点。
- 上一篇:配资股网站合理、真实的项目成本
- 下一篇:没有了







